page d'accueil
|
Adaptations
physiologiques et réponses physiopathologiques du système
cardio-respiratoire à l'altitude
|
etienne.roux@u-bordeaux2.fr
deuxième partie
: Effet de l’altitude sur la fonction respiratoire *
effet de l’altitude sur la pression partielle en oxygène
inhalé *
composition de l’air *
effet de l’altitude *
conséquences sur les pressions et les concentrations en oxygène
et en CO2 dans l’organisme *
pression alvéolaire *
dioxyde de carbone *
oxygène *
diffusion alvéolaire *
pression partielle et concentration dans le sang *
oxygène *
dioxyde de carbone *
conclusion *
effet sur le fonctionnement de l’appareil respiratoire des animaux
de basse altitude *
effet à court terme (1-3 jours) *
activation des chémorécepteurs à la PO2
artérielle
et ces conséquences *
· effet de l’hyperventilation sur
l’oxygène *
· effet sur le dioxyde de carbone
*
· effet du dioxyde de carbone sur
la ventilation *
effet sur la courbe de dissociation de l’oxygène *
effet sur la circulation pulmonaire *
conclusion *
effet à moyen et long terme (2-3 jours à 3-4 semaines) *
ventilation et pH sanguin *
stimulation de l’érythropoïèse *
hypertension artérielle pulmonaire *
hyperréactivité des voies aériennes
*
angiogénèse *
récepteurs moléculaires à l’oxygène
*
physiologie respiratoire des populations vivant en altitude
*
ventilation *
PO2 et PCO2 *
réponse à l’O2, eu CO2 et au pH.
*
hématocrite *
diffusion alvéolo-capillaire / volume pulmonaire
*
conclusion *
éléments de bibliographie *
| Effet
de l’altitude sur la fonction respiratoire |
| effet de l’altitude
sur la pression partielle en oxygène inhalé |
composition de l’air
composition gazeuse de l’air en %
| composant |
% |
| O2 |
20,95 |
| CO2 |
0.05 |
| N2 |
78,09 |
| Argon |
0,93 |
pression atmosphérique au niveau de la mer : 760 mm Hg (101,3
kPa)
La proportion des différents composants de l’atmosphère
est particulièrement stable, et ne varie pas en fonction de l’altitude,
au moins dans la gamme d’altitude où la vie est possible ( à
très haute altitude, la composition de l’atmosphère dépend
de la densité des gaz, et les gaz légers tels que l’hydrogène
et l’hélium se trouvent en quantité plus importante). En
effet, des courants de convection importants assurent un brassage des gaz
bien au delà de la limite de la vie possible.
La composition de l’air sec ne varie pas en fonction des conditions
atmosphériques ou des saisons. Sauf environnement très particulier,
la composition en gaz dans l’atmosphère est stable. Il n’en est
pas de même pour ce qui est de la quantité de gaz présent
en solution dans l’eau, la solubilité de l’oxygène et du
dioxyde de carbone dépendant de nombreux facteurs, en particulier
la température, la teneur en sels (l’oxygène est beaucoup
moins soluble dans l’eau de mer que dans l’eau douce), etc. Ceci n’est
pas sans conséquence sur l’adaptation à la respiration en
milieu aquatique.
L’élément qui varie dans la composition de l’air est la
teneur en vapeur d’eau. L’air contient une quantité plus ou moins
importante de vapeur d’eau. La teneur à l’équilibre – la
pression de vapeur saturante – dépend de la température.
| température |
pression de vapeur saturante |
| 0°c |
4,6 mmHg |
| 37°C |
47 mmHg |
L’humidité relative est le pourcentage de la pression partielle
en vapeur d’eau par rapport à la pression saturante.
Dans un poumon, la vapeur d’eau est égale à la pression
de vapeur saturante, soit 47 mmHg. Par conséquent, la pression de
l’air sec est de 760 – 47 = 713 mmHg. L’air sec contenant 21% d’oxygène,
la PIO2 – pression partielle en O2 dans l’air inhalé
est de 150 mmHg.
effet de l’altitude
Il n’y a pas avec l’altitude de variation de la composition de l’air,
mais diminution exponentielle de la pression barométrique.

À 3000 m, la pression barométrique est diminuée
d’un tiers ; à 5500 m, elle est diminuée de moitié.
Il s’ensuit que la pression partielle en oxygène de l’air est diminuée
dans les mêmes proportions. Si l’on considère l’air inspiré,
cette diminution est encore plus grande, car la pression de vapeur d’eau
saturante ne diminue pas avec la pression barométrique. La proportion
de vapeur d’eau dans l’air inhalé est donc plus importante en altitude
qu’au niveau de la mer, ce qui diminue la proportion des autres gaz, en
particulier d’oxygène et le CO2.
| pressions (en mmHg) |
niveau de la mer |
5500 m |
différence |
| pression atmosphérique |
760 |
380 |
380 |
| PO2 |
160 |
80 |
80 |
| PIO2 |
150 |
70 |
80 |
| PCO2 |
0,23 |
0,11 |
0,12 |
| PICO2 |
0,21 |
0,11 |
0,11 |
| conséquences
sur les pressions et les concentrations en oxygène et en CO2
dans l’organisme |
pression alvéolaire
dioxyde de carbone
Les variations de la pression partielle en oxygène dans l’air
inhalé sont négligeables, de même que leurs conséquences
sur la pression alvéolaire, qui est déterminée par
le débit artériel (Va) et la production de CO2
par l’organisme. Toute chose étant égale par ailleurs, la
PACO2 est inchangée en altitude.
PACO2 = (VCO2/Va)K K : constante
oxygène
Il n’en est pas de même pour la PO2 alvéolaire,
qui dépend de la PIO2. La PO2 alvéolaire
peut être calculée à partir de la formule suivante
:
PAO2 = (PIO2 –( PACO2/R) + F R : quotient
respiratoire K : constante
Puisque la pression alvéolaire en CO2 n’est pas modifiée
lorsque l’altitude augmente, mais que la PIO2 diminue, il s’ensuit
que la pression alvéolaire en O2 diminue en altitude.
diffusion alvéolaire
PO2 dans le sang, en fonction du temps de passage dans
le capillaire, en % de la PAO2 (trait plein : normoxie ; trait
pointillé : hypoxie)
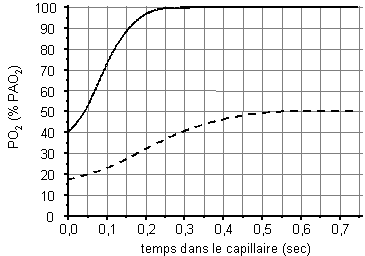
La diffusion alvéolaire dépend du gradient de concentration
entre la pression alvéolaire et la pression artérielle en
oxygène. En altitude, la diminution de la pression alvéolaire
entraîne une diminution du gradient de concentration en oxygène
de part et d’autre de la barrière alvéolo-capillaire, ce
qui entraîne une diminution de la vitesse d’équilibration
des pressions partielles.
Si d’autre part le débit sanguin augmente de manière importante
– par exemple lors qu’un exercice physique intense – il peut arriver que
l’équilibre ne soit pas obtenu. C’est un des rares cas où
le transfert de l’oxygène n’est plus limité par la perfusion
mais par la diffusion.
pression partielle et concentration
dans le sang
oxygène
La diminution de la pression alvéolaire en oxygène se
traduit par une diminution de la pression partielle en oxygène dans
le sang artériel. Ceci influence la quantité d’oxygène
présente dans le sang, mais pas de manière linéaire,
étant donné que la plus grande quantité de l’oxygène
se trouve fixée à l’hémoglobine. La quantité
d’O2 présente dans le sang – en ml O2/100
ml de sang – est donnée par la formule :
(1,39 x Hb x (Sat/100)) + 0,003 PO2
Hb : concentration en hémoglobine du sang (en g/100 ml)
Sat : % de saturation de l’hémoglobine
PO2 en mmHg
La PO2 n’influence directement que faiblement la quantité
d’oxygène présente dans le sang, la majeure partie dépendant
de la saturation de l’hémoglobine. L’examen de la courbe de saturation
montre que tant que la PO2 reste supérieure à
70 mmHg environ, la répercussion de la baisse de la PO2
sur la quantité en oxygène du sang est faible.
dioxyde de carbone
L’altitude n’ayant aucun effet significatif sur la pression alvéolaire
en CO2, il n’y a pas non plus d’effet direct significatif sur
la pression partielle ni la quantité CO2 dans le sang.
Toutefois, la mise en jeu des réponses physiologiques aura des répercussions
importantes sur la quantité de CO2 dans le sang.
conclusion
On voit donc que les effets principaux de l’altitude sont une diminution
de la pression partielle et de la concentration en oxygène dans
le sang artériel, sans modification de ces grandeurs concernant
le CO2. Cette diminution ne s’observe qu’à partir d’un
baisse significative de la pression barométrique, correspondant
à une pression alvéolaire en oxygène de l’ordre de
60 à 70 mmHg.
Cette hypoxémie d’altitude va entraîner une hypoxie tissulaire,
et va donc avoir d’importants retentissements sur le métabolisme
de l’organisme. D’autre part, étant donné que les valeurs
de PO2 artérielle et la concentration sanguine en oxygène
sont des variables intervenant dans la régulation de l’appareil
cardio-respiratoire, le fonctionnement de celui-ci va être modifié.
Concernant l’oxygène, ce qui se passe en altitude ressemble à
ce qui se passe lors d’hypoventilation (baisse de la pression alvéolaire)
ou lors de l’augmentation de la consommation d’oxygène par l’organisme,
dans le cas d’exercice par exemple. Mais, dans ces deux cas, l’hypoxémie
est associée à une hypercapnie, soit par diminution de l’élimination
du CO2 (hypoventilation), soit par augmentation de sa production
(augmentation du métabolisme), alors que ce n’est pas le cas dans
l’hypoxie d’altitude.
| effet sur le fonctionnement
de l’appareil respiratoire des animaux de basse altitude |
Seront traités dans ce chapitre les effets de l’altitude sur
le fonctionnement et éventuellement la structure de l’appareil cardio-respiratoire
d’animaux – dont l’homme – pour lesquels la vie en altitude ne constitue
pas des conditions standard, les conditions standard étant définies
comme celles dans lesquelles s’est déroulée l’histoire évolutive
de l’espèce étudiée. De ce point de vue, le fait d’être
né et d’avoir vécu en altitude ne suffit pas pour autant
à en faire une condition standard. Les particularités du
système respiratoire des hommes natifs des zones d’altitude seront
étudiées en fin de chapitre.
effet à court terme
(1-3 jours)
Les effets de l’altitude seront envisagés à travers son
effet sur les différents systèmes de régulation de
la respiration, en étudiant ses conséquences sur les différents
capteurs correspondants aux variables modifiées primitivement ou
secondairement par l’hypoxie.
activation des chémorécepteurs
à la PO2 artérielle et ces conséquences
La diminution de la PO2 artérielle va activer les
chémorécepteurs sensibles à l’oxygène, présents
essentiellement au niveau des glomus carotidiens. Les cellules de type
I des glomus carotidiens très sensibles à la pression partielle
en oxygène, et une diminution de 15% de celle-ci suffit à
les activer ; elles ne sont pas sensibles à la concentration en
oxygène, à la différences des cellules productrices
d’érythropoïétine, qui sont sensibles à la PO2et
à la concentration en oxygène du sang.
L’activation des chémorécepteurs va entraîner une
hyperventilation réflexe, avec augmentation de la fréquence
respiratoire et du volume courant. D’autre part, l’activation des chémorécepteurs
va stimuler l’appareil cardio-circulatoire, provoquant une tachycardie
et une augmentation du débit sanguin. Cette hyperventilation va
avoir plusieurs conséquences, sur la quantité d’oxygène
dans l’organisme, mais également sur la quantité de CO2,
ce qui va mettre secondairement en jeu d’autres systèmes de régulation.
-
effet de l’hyperventilation sur l’oxygène
L’hyperventilation va entraîner une augmentation de la PO2
alvéolaire, qui dépend à la fois de la PO2
inspirée et de l’extraction de l’oxygène par le sang. Ceci
va entraîner une augmentation de la PO2 artérielle
et, in fine, une meilleure oxygénation des tissus, à
laquelle participe également l’augmentation du débit sanguin
due à la tachycardie. De ce point, l’hyperventilation et la tachycardie
engendrées par la stimulation des chémorécepteurs
à l’oxygène est une réponse adaptée, puisqu’elle
est favorable à l’organisme.
-
effet sur le dioxyde de carbone
L’hyperventilation va avoir une autre conséquence, la diminution
de la pression partielle et de la concentration en CO2 dans
le sang. En effet, elle va augmenter l’élimination de CO2
au niveau des poumons. Cette hypocapnie va avoir plusieurs conséquences,
liées d’une part directement à la diminution de la PCO2,
et d’autre part liées à la perturbation de l’équilibre
acido-basique du sang, l’hypocapnie entraînant une alcalose.
-
effet du dioxyde de carbone sur la ventilation
L’hypocapnie et l’alcalose vont jouer sur les chémorécepteurs
sanguins et périphériques sensibles au CO2. La
réponse liée aux récepteurs périphériques,
sensibles directement au pH et à la PCO2 sanguine, est
immédiate ; celle liée aux récepteurs centraux, sensibles
aux variations du liquide extracellulaire cérébral (LEC)
dans lequel ils se trouvent, est plus lente, mais toutefois plus importante.
En effet, le pH du LEC dépend de celui du liquide céphalo-rachidien
(LCR) qui n’est pas tamponné de manière aussi efficace que
le sang. Les variations de pH sont donc plus importantes au niveau du LEC
que du sang.
L’activation de ces récepteurs va entraîner une diminution
de la ventilation, induisant en retour une diminution de la PO2
alvéolaire, puis artérielle. Il y a là la mise en
jeu de deux boucles de régulation qui conduisent à des résultats
opposés. La conséquence en est une hyperventilation cyclique,
associée à une alcalose plus ou moins importante selon les
individus. En l’occurrence, il ne s’agit pas là d’une réponse
adaptée, dans la mesure où elle est défavorable à
l’organisme, d’une part en limitant l’hyperventilation – et donc l’oxygénation
des tissus – , d’autre part en induisant une alcalose néfaste, voire
mortelle, pour l’organisme.
effet sur la courbe de dissociation
de l’oxygène
courbe de saturation de l’hémoglobine au niveau de la mer
(courbe pleine) et à La Paz (courbe en pointillés)

La courbe de dissociation Hb-O2 est légèrement
déplacée vers la droite. Ceci n’est pas dû à
un effet Bohr – l’alcalose aurait pour conséquence un déplacement
de la courbe vers la gauche – mais à la production accrue de 2,3
diphosphoglycérate (DPG) dans les hématies, qui entraîne
un déplacement de la courbe vers la droite. Cette diminution d’affinité
favorise la libération d’oxygène au niveau tissulaire, mais
diminue sa captation au niveau alvéolo-capillaire, en diminuant
le pourcentage de saturation de l’hémoglobine. On peut se demander
si cette réponse est adaptée ou non, mais il semblerait qu’un
déplacement vers la gauche de la courbe Hg-O2 serait
plus favorable. C’est d’ailleurs ce que l’on observe chez les espèces
génétiquement adaptées à l’altitude (cf. infra).
effet sur la circulation pulmonaire
La diminution de la PO2 alvéolaire entraîne
une vasoconstriction des artérioles pulmonaires, ce qui entraîne
une augmentation de la pression artérielle pulmonaire. Ceci a un
double effet :
-
d’une part l’uniformisation du débit sanguin à l’intérieur
du poumon avec recrutement capillaire, ce qui augmente les zones d’échange
gazeux dans le poumon. Cet effet peut être considéré
comme favorable. On peut noter cependant que ce recrutement capillaire
serait possible sans augmentation importante de la pression artérielle
globale. L’augmentation de débit lié à la tachycardie
suffit à priori à induire un recrutement capillaire. On peut
d’ailleurs noter que des animaux comme le lama ne présente pas de
vasoconstriction hypoxique.
-
augmentation de travail du cœur droit. En effet, l’augmentation de pression
entraîne une augmentation de la postcharge cardiaque droite. En effet,
cette vasoconstriction se traduit par une augmentation des résistances
pulmonaires sans variation du débit sanguin pulmonaire, qui est
imposé par le débit sanguin systémique (la totalité
du sang passe dans le poumon, quelle que soit la pression artérielle
pulmonaire).
L’hypertension artérielle est parfois associée à un
œdème aigu du poumon, une des pathologies du mal aigu des montagnes
(MAM).
conclusion
L’étude des réponses à court terme à l’hypoxie
d’altitude permet de voir qu’il y a mise en jeu de réponses dont
certaines sont adaptées – hyperventilation, tachycardie – et d’autres
non – hypocapnie, alcalose, vasoconstriction hypoxique. Enfin, il y a des
réponses dont on peut se demander si elles constituent une adaptation,
ou tout au moins la meilleure adaptation possible, comme le déplacement
de la courbe Hb-O2 vers la droite.
Il convient de dire qu’on observe une grande variabilité individuelle
dans la réponse, ce qui fait que les conséquences pathologiques
des réponses défavorables, et donc la tolérance à
l’altitude, varie selon les individus. Les troubles liés aux réponses
inadaptées correspondent au mal aigu des montagnes (MAM), qui dans
ses formes graves peut entraîner la mort par œdème aigu du
poumon et/ou œdème cérébral.
Dans les conditions standard, l’hypoxémie et l’hypercapnie vont
en général de pair, alors que ce n’est pas le cas en hypoxie
d’altitude. Ceci explique que les boucles de régulation mises en
jeu dans l’hypoxie amènent à des réponses physiologiques
contradictoires, ce qui n’est pas le cas en conditions standard.
effet à moyen et
long terme (2-3 jours à 3-4 semaines)
ventilation et pH sanguin
Au bout de 2 à 3 jours, l’alcalose sanguine et cérébrale
diminue, d’une part par la mise en jeu de systèmes tampon au niveau
du LCR, d’autre part par l’élimination rénale de bicarbonates.
Le pH sanguin se stabilise à une valeur physiologique, bien que
l’hypocapnie persiste. La diminution du pH diminue la stimulation des chémorécepteurs
sensibles au CO2 et au pH, ce qui a pour conséquence
une régularisation de la respiration, avec une hyperventilation
stable. Ceci se traduit par une élévation de la PO2
et une diminution de la PCO2 alvéolaires. Étant
donné la plus faible densité de l’air en altitude, l’hyperventilation
est facilitée par rapport aux conditions barométriques standard.
évolution des PO2 et PCO2 alvéolaires
au cours du temps lors d’un séjour en altitude
| |
0 h
|
3 h
|
24 h
|
48 h
|
72 h
|
| PAO2 |
52 mm Hg |
53 mm Hg |
61 mm Hg |
61 mm Hg |
61,5 mm Hg |
| PACO2 |
34 mm Hg |
31,5 mm Hg |
29 mm Hg |
28 mm Hg |
28 mm Hg |
stimulation de l’érythropoïèse
L’organisme réagit à l’hypoxie par une augmentation de
l’érythropoïèse. Celle-ci est induite par la production
d’érythropoïétine, produite au niveau du rein. Des études
d’hybridation in situ ont montré que les cellules productrices d’EPO
se situent dans le rein au niveau péritubulaire, à l’interface
entre le cortex et la médullaire externe. Les cellules productrices
d’EPO sont probablement des fibroblastes. La production d’EPO augmente
rapidement pendant 3 à 4 jours, puis décroît, tout
en se maintenant à un niveau supérieur à la normale.
L’hématocrite peut ainsi passer en 3 à 4 semaines de 40-45
% à 55 – 60 % (à La Paz, la limite supérieure
de l’hématocrite normal est de 57 %) ; il peut même atteindre
80 % (polyglobulie pathologique d’altitude), chez des sujets acclimatés
comme chez des sujets natifs.
Cette polyglobulie a plusieurs conséquences. Tout d’abord, l’augmentation
du nombre de globules rouges et par conséquent de la concentration
en hémoglobine du sang va augmenter la concentration en oxygène
dans le sang, pour une PO2 donnée.
On rappelle que la concentration en oxygène du sang est donnée
par la formule :
(1,39 x Hb x (Sat/100)) + 0,003 PO2
Ceci va se traduire par une augmentation de la quantité d’oxygène
disponible au niveau tissulaire.
D’autre part, cette polyglobulie entraîne une augmentation importante
de la viscosité du sang conduisant à des troubles de la circulation,
en particulier de la circulation cérébrale, voire à
des thromboses.
La polyglobulie d’altitude est-elle une réponse adaptative de
l’organisme ? S’il paraît évident que la polyglobulie pathologique
d’altitude est, comme son nom l’indique, une réponse inappropriée
de l’organisme, la réponse est plus difficile pour la polyglobulie
modérée. Classiquement, on considère qu’il s’agit
d’une réponse adaptée, puisqu’elle augmente la concentration
en oxygène dans le sang, et augmente par ailleurs les performances
sportives. Toutefois, certains considèrent qu’il ne s’agit pas d’une
réponse adaptative correcte, la polyglobulie engendrée étant
supérieure à celle requise pour une efficacité optimale.
Un des arguments avancés est que la polyglobulie d’altitude s’observe
chez les sujets acclimatés et les sujets natifs des montagnes d’Amérique
latine – dont le peuplement est relativement récent –, alors qu’elle
s’observe nettement moins chez les populations des hauts plateaux tibétains
et himalayens – dont le peuplement est plus ancien. La diminution de la
réponse polyglobulique à l’altitude est ici considérée
comme un début d’adaptation génétique des populations
asiatiques à l’altitude.
hypertension artérielle pulmonaire
La vasoconstriction hypoxique engendrée par la diminution de
la PO2 alvéolaire conduit à une hypertension artérielle
pulmonaire (HTAP) chronique, associée à des remaniements
de la structure des artères pulmonaires. Cette HTAP a des répercussions
cardiaques, en particulier une hypertrophie ventriculaire droite due à
l’augmentation de la postcharge. Ces modifications cardio-pulmonaires peuvent
être étudiés chez le rat placé en caisson hypobare,
celui-ci permettant de simuler une montée en altitude.
Après un séjour de 15 jours en caisson hypobare à
une altitude simulée de 5500 m, la pression artérielle pulmonaire
passe chez le rat de 20 mmHg à 32 mm Hg.
Le remodelage de la paroi artérielle pulmonaire est visible au
niveau de :
-
l’intima : épaississement des couches endothéliales et sous-endothéliales
;
-
la média : augmentation de la production de collagène et
de l’élastine ; modification du nombre et de l’architecture des
lames élastiques ; augmentation de la quantité de muscle
lisse ; L’augmentation de l’épaisseur de la média et de la
quantité de muscle lisse peut être quantifiée par des
mesures morphométriques :
| conditions |
surface de muscle lisse par µm de paroi
interne (µm2) |
nombre de noyaux par unité de surface
(cell. / mm2) |
épaisseur de la média
(µm) |
| normoxique |
167 ± 7 |
965 ± 37 |
0,22 ± 0,01 |
| hypoxiques |
309 ± 9 |
656 ± 24 |
0,47 ± 0,02 |
-
l’adventice : prolifération et hypertrophie des fibroblastes adventiciels
et augmentation de la production de collagène de type I.
D’autre part, il semble que la réactivité du muscle lisse
ainsi que sa signalisation calcique puissent être modifiées
lors d’HTAP. En effet, la stimulation de la cellule musculaire lisse de
l’artère pulmonaire de rats normoxiques par divers agonistes contractants,
comme l’ATP, l’endothéline 1 ou l’angiotensine II, entraîne
une réponse oscillante. En revanche, ces oscillations disparaissent
dans les cellules obtenues à partir d’artère pulmonaire de
rats maintenus pendant 15 jours en hypoxie d’altitude (5500 m). Le pourcentage
de cellules répondantes diminue également. ces modifications
de la signalisation calcique sont probablement en rapport avec les remaniements
musculaires observés en étude morphométrique.
| conditions |
VD (mg) |
VGS |
VD/VGS |
n |
| normoxique |
167 ± 7 |
965 ± 37 |
0,22 ± 0,01 |
8 |
| hypoxiques |
309 ± 9 |
656 ± 24 |
0,47 ± 0,02 |
16 |
VD : ventricule droit
VGS : ventricule gauche + septum
L’hypertension artérielle pulmonaire est ainsi associée
à une remodelage important de la paroi de l’artère pulmonaire,
ainsi qu’à des modifications fonctionnelles du muscle lisse, dont
la caractérisation complète demeure à faire. L’importance
de l’HTAP dépend de l’altitude, et si les modifications morphologiques
et fonctionnelles observés chez le rat placé à une
altitude simulée de 5500 m, il faut voir qu’il s’agit d’une altitude
supérieure à celle où une vie permanente est possible
pour les humains (les habitations permanentes d’êtres humains se
situent vers 5000 m).
hyperréactivité des voies
aériennes
L’hypoxie chronique ne semble pas modifier uniquement la réactivité
du muscle lisse vasculaire pulmonaire, mais également celle du muscle
lisse des voies aériennes. il a été montré
que l’hypoxie aiguë pouvait entraîner une hyperréactivité
des voies aériennes, mais peu de travaux ont été effectués
sur l’effet de l’hypoxie chronique. Cependant, des travaux menés
sur le rat en conditions hypobares ont montré que l’hypoxie entraînait
une augmentation de la sensibilité des voies aériennes, et,
au niveau cellulaire, une modification de l’homéostasie calcique.
Des études effectuées sur le rat ont montré que l’hypoxie
d’altitude chronique (2 semaines à 5500 m) entraînait une
modification de la réactivité des voies aériennes,
en particulier une hypersensibilité à la srimulation muscarinique.
Cette hypersensibilité est retrouvée au niveau du signal
calcique. En effet, la modification de la réponse calcique de myocytes
des voies aériennes de rats hypoxiques chroniques correspond, à
la différence de ce qui est observé dans l’artère
pulmonaire, à une augmentation de la fréquence des oscillations
calciques.
angiogénèse
L’hypoxie stimule par ailleurs la néoformation de capillaires
sanguins. Cette prolifération des vaisseaux sanguins résulte
de l’activité de facteurs de croissance, parmi lesquels le VEGF,
le PDGF, le placental growth factor et le transforming growth
factor B-1. Le VEGF (vascular endothelial growth factor) stimule
la mitogénèse des cellules endothéliales et la prolifération
capillaire. Peu d’études ont été réalisé
pour déterminer la production de VEGF en réponse à
l’hypoxie. Chez le rat, il a été montré qu’une exposition
pendant 6 h à 8,5 % d’oxygène dans l’air (la proportion normale
est de 21 %) entraînait une augmentation de l’expression du gène
du VEGF dans le rein, le cerveau et les muscles squelettiques.
La signification physiologique d’une prolifération capillaire
est une meilleure oxygénation des tissus. En effet, la distance
moyenne entre le sang oxygéné et les tissus est diminuée,
ce qui favorise les échanges gazeux par diffusion.
récepteurs moléculaires
à l’oxygène
On voit que la réponse à l’hypoxie ne concerne pas uniquement
la stimulation des chémorécepteurs des glomus carotidiens
et aortiques et la mise en jeu de systèmes réflexes, mais
également un certain nombre de types cellulaires différents
: cellules productrices d’EPO dans le rein – et dans le foie fœtal –, cellules
musculaires lisses, cellules endothéliales, etc.
Si ces cellules sont capables de répondre spécifiquement
à l’hypoxie, la question se pose de savoir quel est le capteur sensible
à l’oxygène au niveau moléculaire dans ces cellules.
(Au niveau cellulaire, la plupart sinon toutes les cellules sont sensibles
à l’hypoxie, au sens où la privation d’oxygène active
des mécanismes moléculaires et métaboliques, y compris
chez les levures et les bactéries. La présence de pigments
sensibles à l’oxygène est ubiquitaire, des procaryotes aux
métazoaires.)
Les mécanismes moléculaires expliquant la sensibilité
à l ‘hypoxie des cellules du glomus carotidien et des cellules productrices
d’EPO ont été étudiés sur des lignées
de cellules en culture (concernant l’EPO, la plupart des résultats
ont été obtenus sur des lignées cellulaires productrices
d’EPO provenant de tumeurs hépatiques). Sans entrer dans le détail
des mécanismes moléculaires impliqués dans la production
d’EPO, on peut dire que le capteur moléculaire à l’oxygène
est selon toute probabilité une protéine héminique,
dont la nature demeure discutée. La présence ou l’absence
d’oxygène correspond à un changement conformationnel de l’hème
et par suite une modification de la fonction de la protéine héminique.
physiologie respiratoire
des populations vivant en altitude
Les modifications physiologiques, et éventuellement morphologiques
– comme la prolifération capillaire – induite par un séjour
prolongé de quelques semaines en altitude persistent autant que
dure la vie en altitude, et se retrouvent globalement chez les populations
qui sont nées dans ces conditions d’hypoxie ; toutefois, des différences
existent entre les personnes acclimatés à l’altitude (c’est-à-dire
qui sont nés dans des conditions normoxiques avant de vivre en altitude)
et les personnes natives.
ventilation
Les sujets nés en altitude présente un débit ventilatoire
moindre que les sujets des plaines déjà acclimatés
à l’altitude. L’hyperventilation est donc moins marquée chez
les sujets natifs et résidents permanents que chez les sujets acclimatés.
PO2 et PCO2
Les pression partielles en oxygène et en gaz carbonique sont
grosso modo les mêmes chez les sujets natifs et les sujets acclimatés.
La pression alvéolaire en O2 et en CO2 diminue
corrélativement à l’altitude de vie.
| altitude |
PB (mm Hg) |
PaO2 (mm Hg) |
PaCO2 (mm Hg) |
| 3244 m |
520 |
65 |
32 |
| 3600 m |
495 |
60 |
30 |
| 4000 m |
462 |
52 |
27 |
pression atmosphérique (PB), PO2 artérielle
(PaO2) et PCO2 artérielle (PaCO2)
moyennes à La Paz, en fonction de l’altitude
réponse à l’O2,
eu CO2 et au pH.
les populations natives présentent, par rapport aux personnes
acclimatées, une moins grande sensibilité aux variations
d’oxygène, de gaz carbonique et de pH, qui malgré tout demeure.
Par exemple, l’inhalation d’oxygène pur entraîne une diminution
du débit ventilatoire de 10 % chez les sujets vivant au niveau de
la mer. À 3500 m, cette diminution est de 30 % chez les nouveaux
arrivants, alors qu’elle n’est que de 15 % chez les personnes natives.
Chez certains sujets, la sensibilité à l’oxygène
disparaît totalement. Cette disparition est associée à
la polyglobulie pathologique d’altitude.
hématocrite
L’hématocrite des populations natives est élevé.
Alors que l’hématocrite normal d’une population vivant au niveau
de la mer est de 40 à 45 %, celui des habitants de La Paz est considéré
comme normal jusqu’à 57 %. De plus, il existe fréquemment,
y compris chez les populations natives, une polyglobulie pathologique,
au cours de laquelle l’hématocrite peut facilement atteindre 80
%.
diffusion alvéolo-capillaire
/ volume pulmonaire
La diffusion alvéolo-capillaire est nettement supérieure
chez les sujets natifs d’altitude par rapport aux sujets acclimatés.
Cette augmentation de la diffusion alvéolo-capillaire peut s’expliquer
par une augmentation de la surface d’échange, liée à
une surface alvéolaire et un lit capillaire augmentés, associée
à un plus grand volume pulmonaire global.
diffusion alvéolo-capillaire (DLCO, ml/min/mm Hg)
corrigées en fonction de la concentration en hémoglobine
chez les enfants au niveau de la mer et en altitude (la Paz)
| |
filles |
garçons |
| niveau de la mer |
7,7 ± 2,0 |
7,1 ± 1,9 |
| La Paz |
13,1 ± 2,7 |
14,2 ± 1,9 |
Il a été montré que la capacité vitale est
augmentée de 10 à 18 % chez les natifs d’altitude par rapport
aux résidents du niveau de la mer. De plus, une étude portant
sur des natifs de La Paz (3660 m) transplantés dans une zone de
basse altitude (420 m) a montré que les volumes pulmonaires restent
plus élevés que ceux du groupe témoin, natif de basse
altitude.
Cette augmentation des volumes pulmonaires – observés chez l’homme
et chez l’animal – semble conditionnée par les facteurs liés
au développement. En effet, l’augmentation des volumes pulmonaires
i) se trouve chez les natifs d’altitude et non chez les résidents
acclimatés et ii) persiste chez les natifs d’altitude transplantés
à basse altitude.
De plus, des études effectuées chez le rat ont montré
que des rats nouveau-nés, après exposition prolongée
à l’altitude, possédaient un développement alvéolaire
avancé et une croissance accélérée de la surface
alvéolaire d’échange et des volumes pulmonaires ; à
l’inverse, l’exposition prolongée à l’altitude de rats adultes
ne modifient significativement ni le nombre d’alvéoles, ni le volume
pulmonaire.
Cependant, les modifications irréversibles observées chez
les animaux élevés en altitude ne sont pas pour autant héréditaires.
conclusion
L’étude des modifications du fonctionnement et éventuellement
de la structure de l’appareil cardio-respiratoire en altitude a permis
de mettre en évidence plusieurs niveaux de modifications des réponses
fonctionnelles :
-
les réponses à court terme
-
les réponses à moyens terme
-
les réponses des natifs
Les réponses à court et moyen terme sont dues à la
mise en jeu de système de régulation qui ne sont pas a priori
adaptés à la situation d’hypoxie d’altitude, dans la mesure
où celle-ci ne correspond pas aux conditions standard. Parmi ces
réponses, on peut constater à posteriori que certaines sont
adaptées, et certaines ne le sont pas ; enfin, certaines sont adaptées
dans certaines limites de la réponse mais peuvent devenir inadaptées
parce que la réponse est trop importante. C’est ce que l’on appelle
l’hyperexis (par exemple, la polyglobulie pathologique d’altitude). Ces
réponses, que l’on peut qualifier de physiologiques – au sens où
elles mettent en jeu des systèmes de régulation physiologiques
– sont réversibles.
Chez les natifs d’altitude, ces réponses physiologiques peuvent
être modulées (par exemple la sensibilité à
l’oxygène ou au pH). D’autre part, il apparaît un nouveau
degré de réponse qui concerne l’effet de l’altitude sur la
biologie du développement. On peut qualifier ces réponses
de " développementales " – si on ose utiliser ce néologisme.
Elles sont à priori irréversibles, mais non héréditaires.
On peut se demander si, pour un natif, la vie en altitude de constitue
pas des conditions standard. Bien que ça puisse être le cas,
ce n’est pas systématique. Le fait que les conditions de vie constituent
des conditions standard – telles que précédemment définies
– suppose que l’historie évolutive des individus se soit déroulée
dans ces conditions. Mais où commence l’histoire évolutive
? La réponse n’est pas simple, mais on peut dire qu’à partir
du moment où on a mis en évidence une réponse adaptative
spécifique aux contraintes du milieu et génétiquement
transmissibles, on peut considérer que l’on " commence " à
être dans des conditions standard. La question peut se poser concrètement,
comme on l’a vu pour la polyglobulie d’altitude, que l’on trouve chez les
populations d’altitude d’Amérique latine, mais pas d’Asie.
On peut donc classer les réponses à l’altitude en plusieurs
niveaux :
réponses " physiologiques " :réversibles
réponses " développementales " : irréversibles,
mais non héréditaires
réponses " génétiques " : héréditaires
Les réponses génétiques à l’altitude seront
examinés dans le prochain chapitre, consacré à la
physiologie respiratoire des animaux adaptés à la vie en
altitude, comme le lama et l’oie de l’Himalaya.
Il ne faut pas oublier également que l’on peut considérer
un autre niveau d’adaptation, l’adaptation comportementale, qui peut être
génétique ou culturelle. Cette question ne sera pas traitée
ici.
suite :
troisème
partie : physiologie cardio-respiratoire des animaux adaptés
à l’altitude
éléments
de bibliographie
retour sommaire
page d'accueil


